引言:当标准方案遇到特殊突变
非小细胞肺癌(NSCLC)的同步放化疗后使用度伐利尤单抗巩固治疗,已成为不可切除III期患者的全球标准。肿瘤的分子异质性意味着并非所有患者都能同等获益。其中,KEAP1和NFE2L2(编码NRF2蛋白)基因的突变,正成为一个关键的预测性与耐药性生物标志物。本次讲解将探讨这一特殊突变背景如何与免疫治疗“喜结良缘”,即从对立挑战转化为潜在的精准治疗机遇。
第一部分:主角介绍——KEAP1/NFE2L2通路与免疫微环境
- 正常功能:KEAP1是NRF2的负调控因子。在氧化应激下,KEAP1失活,NRF2入核,启动一系列抗氧化和细胞保护基因的表达,维持细胞稳态。
- 突变后果:KEAP1功能丧失突变或NFE2L2激活突变,会导致NRF2通路持续异常激活。
- 与免疫的“矛盾”:这条通路的持续激活,一方面可能增强肿瘤细胞对放化疗所致氧化损伤的抵抗(导致放化疗疗效不佳),另一方面会重塑肿瘤免疫微环境,例如通过代谢重编程(如增加糖酵解、谷氨酰胺代谢)营造一个免疫抑制性的肿瘤微环境,理论上可能削弱以度伐利尤单抗为代表的PD-L1抑制剂的疗效。
第二部分:临床现实——“良缘”前的挑战
大量回顾性数据表明,携带KEAP1/NFE2L2突变的NSCLC患者:
- 对同步放化疗的应答率相对较低。
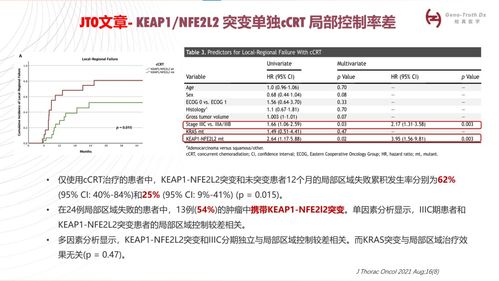
- 在接受免疫检查点抑制剂(包括度伐利尤单抗)治疗时,无进展生存期(PFS)和总生存期(OS)获益显著受限。在PACIFIC模式中,这类突变患者可能属于预后较差的亚组。
- 突变可能与吸烟史较少的患者群体相关,而这部分患者本身的肿瘤突变负荷(TMB)可能较低。
这似乎是一段“不和谐”的关系,突变成为了疗效的“绊脚石”。
第三部分:转机与“喜结良缘”——机制启示与联合策略
真正的“喜结良缘”并非忽视矛盾,而是基于深刻理解,找到协同破局之道。研究揭示了KEAP1/NFE2L2突变肿瘤的独特弱点,为联合治疗提供了靶点:
- 靶向代谢弱点:NRF2激活导致谷氨酰胺代谢依赖。联合使用谷氨酰胺酶抑制剂(如Telaglenastat),可能剥夺肿瘤细胞的能量和生物合成原料,逆转免疫抑制,与度伐利尤单抗产生协同作用。
- 克服抗氧化屏障:异常活跃的抗氧化系统保护了肿瘤细胞。联合使用NRF2抑制剂或增加氧化应激的药物(如某些化疗药或放疗增敏剂),可能打破其防御,增强免疫原性细胞死亡,从而提高免疫治疗疗效。
- 调节肿瘤微环境:针对该通路下游招募的免疫抑制细胞(如Tregs, M2型巨噬细胞),可考虑联合其他免疫调节剂。
第四部分:未来展望——精准下的“良缘”
将KEAP1/NFE2L2突变从单纯的负面预测标志物,转化为可操作的联合治疗指导标志物,是实现“喜结良缘”的关键。未来方向包括:
- 前瞻性临床试验验证:设计专门针对该突变人群的临床研究,评估度伐利尤单抗联合上述靶向药物的安全性与有效性。
- 多维生物标志物整合:结合PD-L1表达、TMB、STK11共突变等,更精细地划分患者亚群。
- 治疗时机探索:是巩固治疗时联合,还是更早地在同步放化疗期间介入?
###
在NSCLC同步放化疗后度伐利尤单抗巩固治疗的时代,KEAP1/NFE2L2突变初看是“良缘”的阻碍。但通过深入的基础研究,我们正将其转化为一个行动指南。它不是简单的“无效”标签,而是指向了“如何联合治疗可能有效”的路线图。从识别挑战到利用其生物学特性设计精准联合方案,我们正在促成一段基于科学理解的、真正的“喜结良缘”,旨在为这部分难治性患者带来新的曙光。